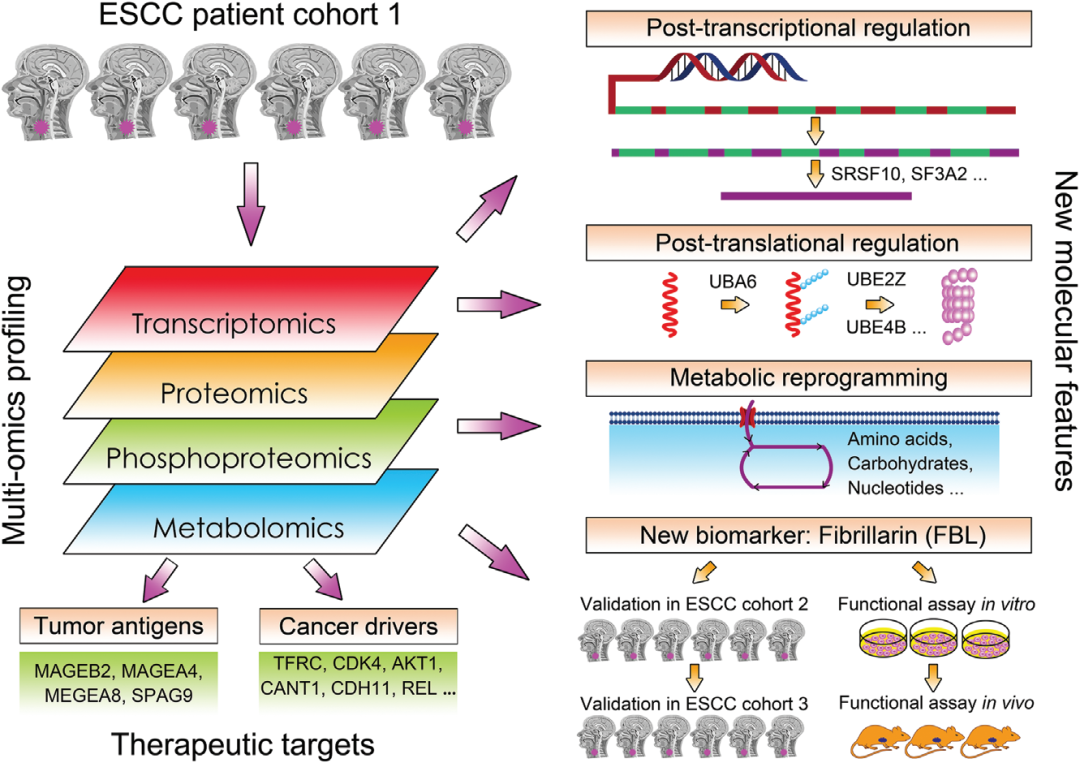
鉴于单独的基因组信息的有限性,上海中医药大学附属龙华医院、上海市中医药研究院中医肿瘤研究所陈文连团队联合江苏省南通市肿瘤医院王伟团队以及香港浸会大学贾伟团队等多个科研单位合作从多组学(转录组+蛋白质组+磷酸化蛋白质组+代谢组)层面上揭示了食管鳞状细胞癌的分子特征及潜在治疗靶点。研究成果以“A multi-omics study delineates new molecular features and therapeutic targets for esophageal squamous cell carcinoma”为题,发表在Clinical and Translational Medicine(IF:8.554)上。

多组学样本分组设置及临床特征
1. 人转录组RNA测序+DIA蛋白质组+磷酸化蛋白质组+代谢组:
食管鳞状细胞癌癌组织(ESCC):n=24
食管鳞状细胞癌正常癌旁组织(NAT):n=24
注:由于组织样本量有限,仅有三对样本进行了磷酸化蛋白质组学检测。
2. 人食管鳞状细胞癌患者的临床特征:
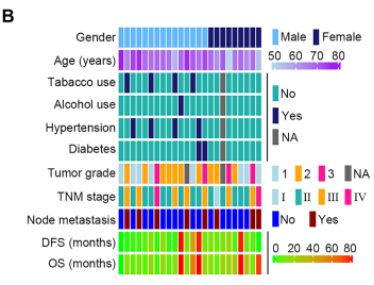

DIA蛋白质组共检测了6507个蛋白,保留在超过50%样本中有定量值的共计5511个蛋白进入下游分析。磷酸化蛋白质组共检测到来自3215个蛋白上的共11232个磷酸化位点,保留无定量缺失值的来自2740个蛋白的7186个磷酸化位点进入下游分析。代谢组保留在超过50%样本中有定量值的共计200个代谢物进入下游分析。
1. 食管鳞状细胞癌(ESCC)的多组学分子景观
(1)与已有的转录组RNA测序数据比较
在已经报道的53对ESCC癌和癌旁组织的转录组RNA测序结果中,癌 vs 癌旁共有116个上调基因和43个下调基因。其中,116个上调基因中的76个(65.52%)、43个下调基因中的32个(74.41%)在本研究的RNA测序结果中出现了一致的变化趋势。这表明本结果与已报道结果的一致性。
(2)ESCC癌组织和癌旁组织在多组学层面上有明显的差异
研究者随后分别从转录组(基因mRNA表达和mRNA异构体(isoform)层面)、蛋白质组、磷酸化蛋白质组和代谢组层面对所有样本分别进行非监督的表达量聚类分析及整合多组学聚类。结果表明,在各种组学层面及整合多组学层面上,ESCC癌组织和癌旁组织都有明显的差异。最后,研究者是用DIABLO算法计算了个各组学间的相关性。结果显示,任意两个组学间都有高的相关性,这表明ESCC组织和癌旁组织之间的差异性在各个组学层面上是一致的。
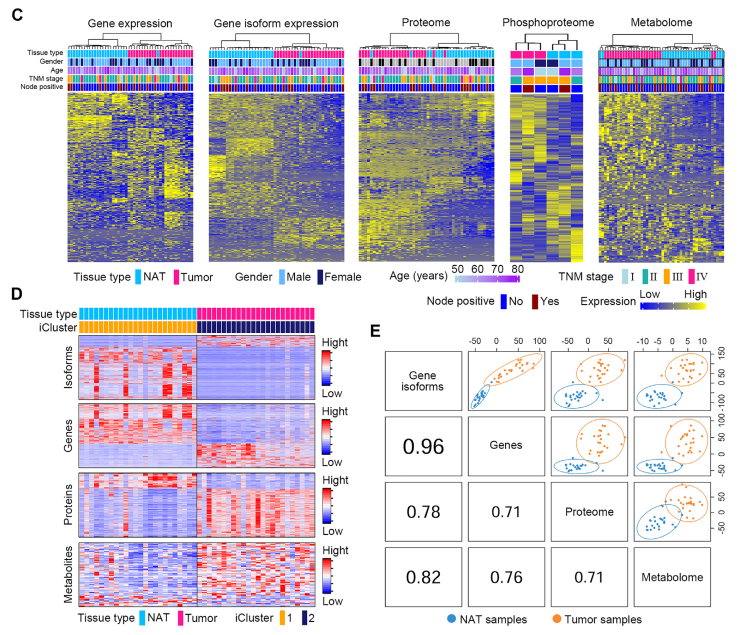
正常小鼠和食管癌小鼠的食管组织转录组RNA测序和代谢组学结果分析也显示出显著的差异。这表明,ESCC癌组织和正常组织间的差异性在物种间的保守性。
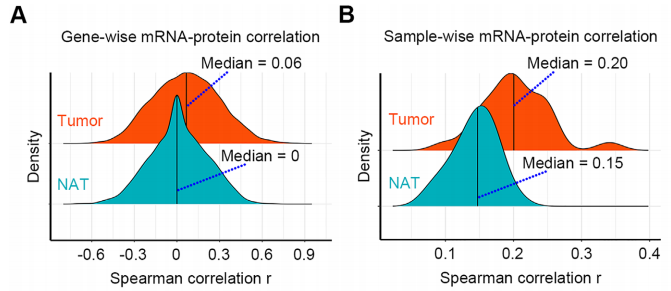
2. 转录组和蛋白质组的不一致性表明了广泛的转录后和翻译后调控
基因的表达经历转录成mRNA和mRNA翻译为蛋白的两个主要过程。研究者比较了在转录组和蛋白质组层面上的相关性(共6174个mRNA-蛋白质对)。结果表明,癌组织和癌旁组织的mRNA和蛋白质之间的相关性很低。在癌和癌旁组织中,基因层面上的mRNA的蛋白质相关性中位值分别为0.06和0,而样本层面上的mRNA和蛋白质相关性中位值分别为0.20和0.15。该结果意味着在组织中存在着广泛的转录后和翻译后调控。
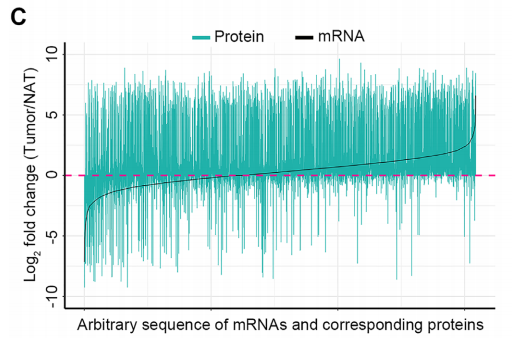
研究者继续比较了癌 vs 癌旁组织mRNA变化倍数从下调到上调的顺序增长过程中,相应蛋白质的表达变化情况。总体来看,在癌组织中有更多的表达上调的蛋白质,且不管是mRNA变化下调、不变和上调,都有相应的蛋白质发生上调变化。同样地,癌组织中也有更多的上调mRNA。这些结果表明,癌组织的mRNA转录和翻译增强,且有更活跃的转录后调控。
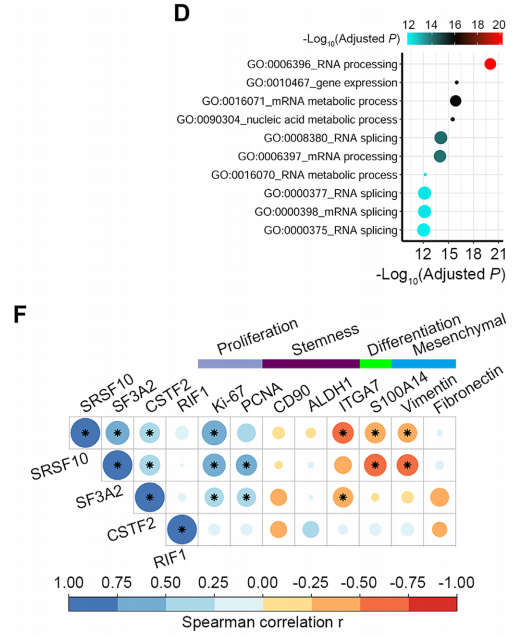
研究者假设在mRNA和蛋白水平均上调的基因(定义为高转录和高翻译活性的基因)是导致可以观测到的癌和癌旁组织间的差异的核心上游信号。于是对这部分共480个基因进行了GO功能富集分析,显示了RNA加工、RNA剪接和基因表达的活性在ESCC组织中的显著增强。这些基因中包括了在癌组织中蛋白表达量非常高的富含丝氨酸/精氨酸的剪接因子10(SRSF10)、剪接因子3A亚基2(SF3A2)、切割活化因子2(CSTF2)和复制时间调节因子1(RIF1)。在ESCC癌组织蛋白质组结果中SRSF10、SF3A2,和CSTF2表达量与增殖标志物 Ki-67和/或PCNA正相关。此外,SRSF10 和SF3A2与分化标志物S100A14负相关。这些结果表明,SRSF10、SF3A2和CSTF2 可能较活跃地参与了ESCC的恶性进展。
3. 整合分析ESCC的分子通路和代谢特征
因为mRNA和蛋白的高度不一致,研究者使用蛋白质组、磷酸化蛋白质组和代谢组进一步分析人ESCC中的分子改变。
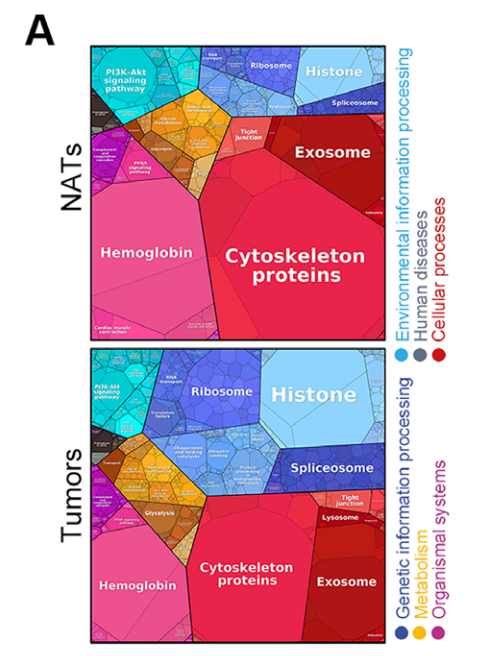
(1)蛋白质组:癌 vs 癌旁共得到2890个差异蛋白。差异蛋白的KEGG通路富集分析显示ESCC肿瘤中有更高水平的剪接体、组蛋白和核糖体相关蛋白,以及低水平的细胞骨架蛋白。研究者继续使用GSVA对差异蛋白的活性进行量化,在ESCC中共发现了157个显著变化的通路,包括与RNA转录/加工/代谢、DNA合成和修复、蛋白合成、蛋白水解和细胞周期相关的通路。而与细胞连接、细胞间相互作用相关的通路则减弱。
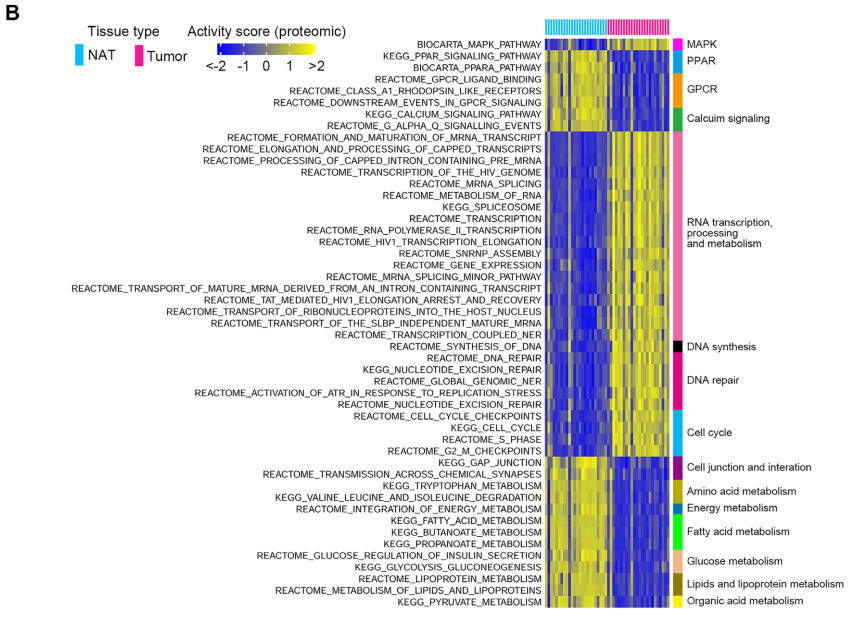
(2)磷酸化蛋白质组:癌 vs癌旁共得到517个差异磷酸化位点。研究者对这些差异磷酸化位点的归属蛋白进行GSVA分析,结果显示在ESCC肿瘤中存在着参与RNA转录、加工和代谢的通路的激活。

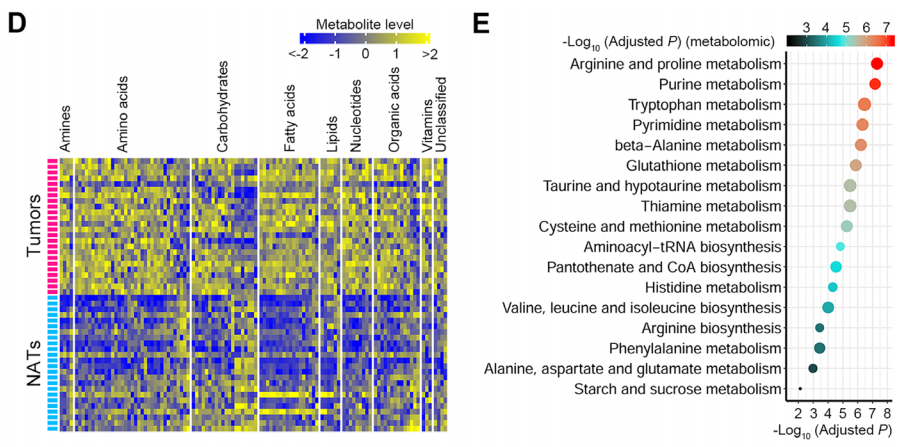
(3)代谢组:癌 vs癌旁共从200个代谢物中筛选得到113个差异代谢物(占比56.50%)。其中94个差异代谢物上调(占比83.19%)。差异代谢物的MESA分析显示,有17个代谢通路在ESCC肿瘤中有显著扰动。其中10个通路参与氨基酸代谢,这表明在人类ESCC中的氨基酸代谢受到主要干扰。而一个ESCC细胞系KYSE150细胞培养上清的分析显示,ESCC细胞消耗了更多的氨基酸包括胱氨酸、精氨酸、脯氨酸及其他氨基酸。
(4)整合分析:研究者利用蛋白质组和代谢组的结果对最受干扰的精氨酸和脯氨酸代谢通路进行整合网络分析,结果表明ESCC肿瘤选择性表达多个代谢酶,以加速氨基酸的生产。另外,考虑到代谢物在细胞表型决定中的重要作用,研究者分析了能表征ESCC重要细胞表型的差异蛋白物和差异蛋白质间的相关性。13个代谢物与乙-醛脱氢酶1(ALDH1,一个ESCC干性标志物)正相关。该结果表明,变化的代谢物可能参与影响ESCC的干性。
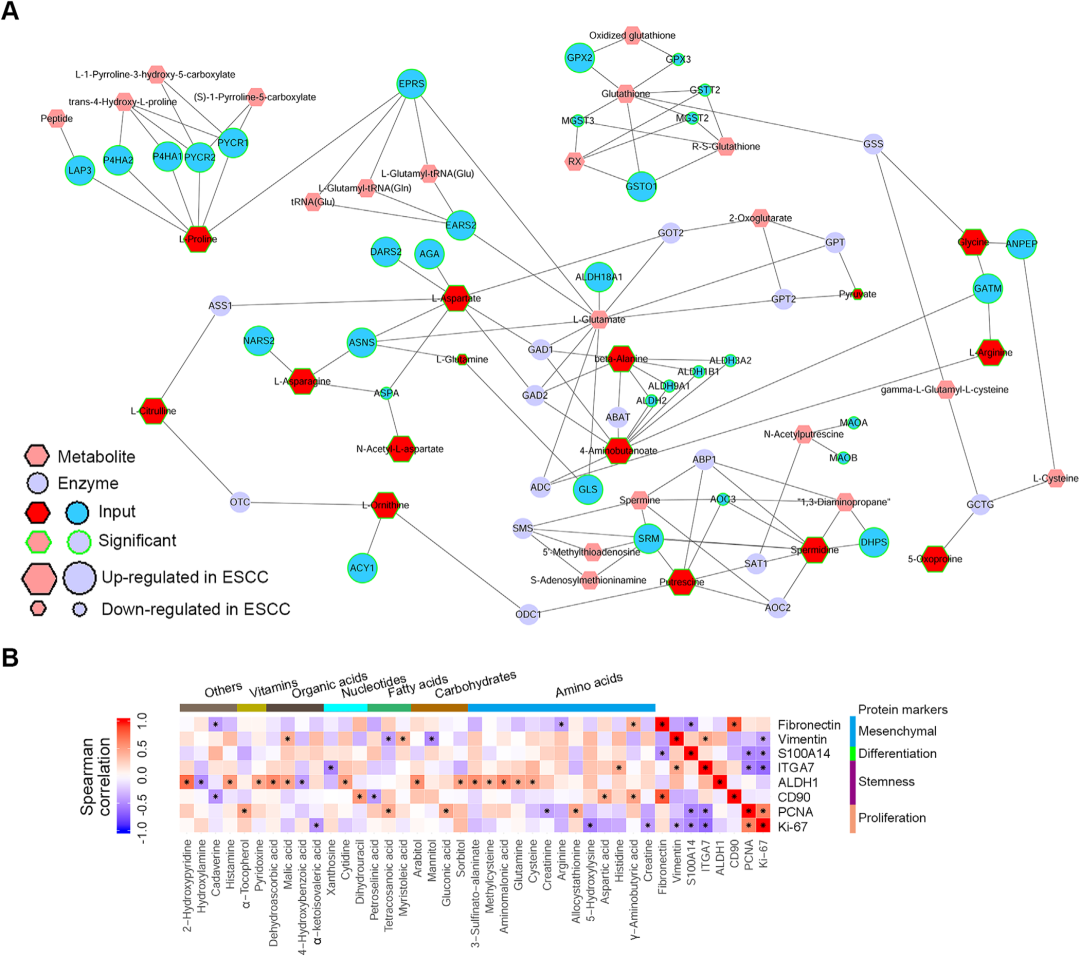
4. 鉴定有预后潜力的蛋白标志物(上调差异蛋白质)
接下来, 研究者通过分析ESCC癌 vs 癌旁的差异蛋白寻找与患者生存相关及参与ESCC进展的蛋白。单因素Cox模型分析共得到118个有预后潜力的蛋白。这其中,66个蛋白与疾病复发或死亡风险正相关,而剩余蛋白与疾病复发或死亡风险负相关。KEGG富集分析显示,这118个蛋白主要富集在吞噬体、补体和凝血级联、P53信号通路、果糖和甘露糖代谢等通路。
66个与疾病复发或死亡风险正相关的蛋白中有23个蛋白的蛋白和mRNA表达变化趋势一致,表明这些蛋白是受到转录水平的调控。而其他蛋白的蛋白变化趋势和mRNA变化趋势不一致,表明是受到转录后调控。值得注意的是,14个基因,包括HACD2、RBM3、MRPL14、PCNP、XPNPEP3、TBC1D5、BPTF、CEP170B、PTPN13、NAA50、SNRPF、NUP43、FBL和CHCHD2在蛋白质和mRNA水平上都明显上调。研究者在4-NQO(4-**喹-啉 N-氧化物)诱导的ESCC小鼠中检测了这些基因的mRNA转录。其中3个基因,RBM3、BPTF和FBL,在ESCC小鼠的食道组织中相对于对照组小鼠明显增加,表明这三个基因在ESCC中的上调在不同物种中是保守的。接下来,研究者选择了5个在ESCC肿瘤中上调最多的蛋白,包括HACD2、RBM3、MRPL14、PCNP和XPNPEP3,以及BPTF和FBL进行进一步研究。
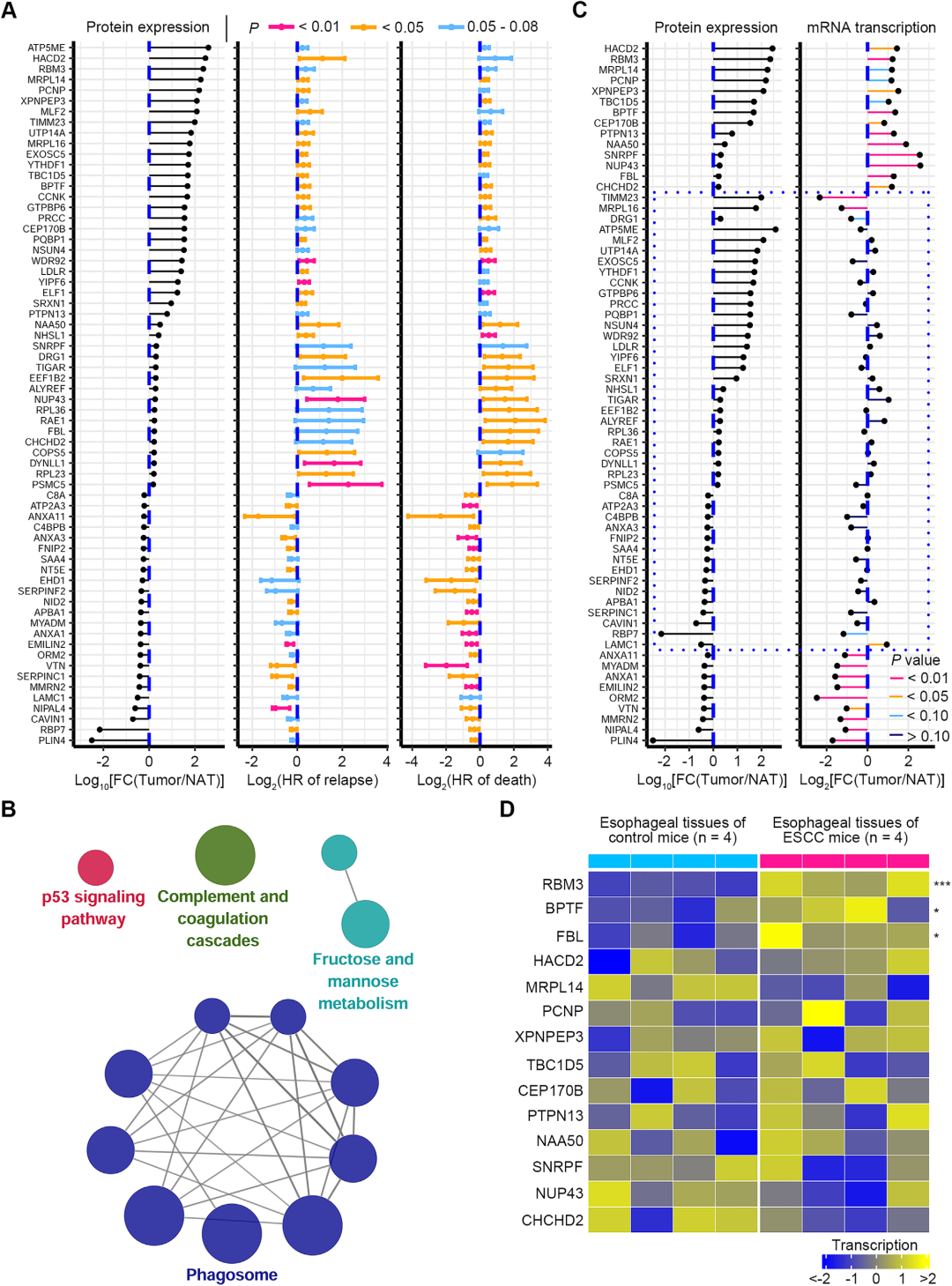
5. FBL可作为不利预后的生物标志物
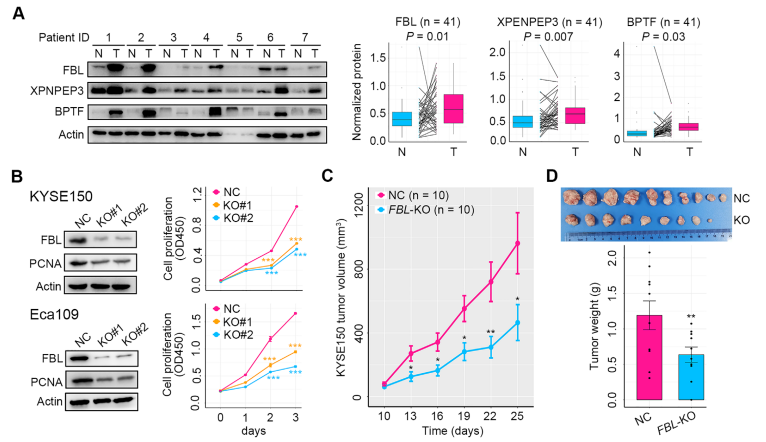
研究者在第二个队列(n=41)组织样本中检测了前述7个蛋白的表达量,并评估这些蛋白的预后潜力。结果表明,FBL、XPNPEP3和BPTF在癌组织中显著上调。研究者继续在ESCC细胞系敲减FBL、XPNPEP3和BPTF,检测这三个基因对ESCC恶性的影响。结果表明,FBL缺失显著下调细胞增殖标志物PCNA的表达,并且显著抑制ESCC细胞的生长。此外,FBL缺失显著抑制了PI3K/AKT信号通路,该通路是促进细胞G1/S期转换的重要信号通路。体内动物水平上的结果显示,FBL缺失显著抑制移植瘤小鼠肿瘤的生长。而XPNPEP3和BPTF并未影响ESCC细胞的生长。综合以上结果表明,是FBL而非XPNPEP3和BPTF,通过激活PI3K/AKT信号通路,促进细胞G1/S期转换,在ESCC细胞生长中发挥重要作用。
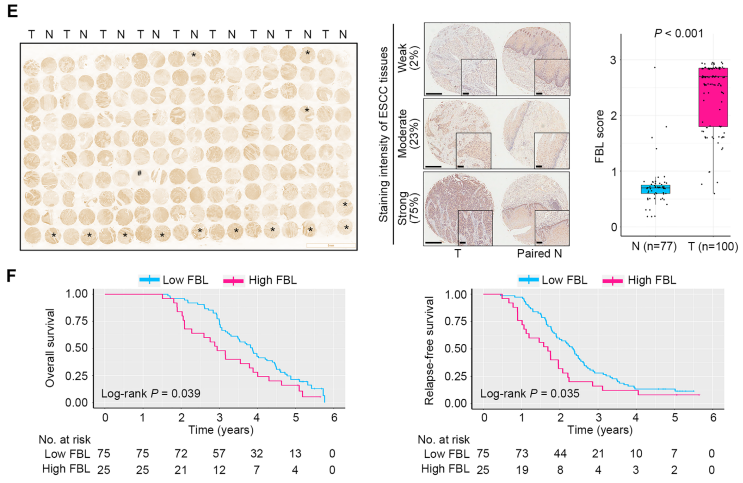
紧接着,研究者在第三个ESCC队列(n=100)中使用IHC检测了FBL的表达,结果证实了FBL在ESCC肿瘤中的高表达。重要的是,高的FBL蛋白表达预示着ESCC患者的总生存率和无复发生存率较低。而TCGA RNA-seq数据的分析显示,FBL的高mRNA水平与ESCC患者糟糕的总生存率无关,这表明FBL mRNA与ESCC患者的预后没有关系。总体,这些发现表明,肿瘤组织中高表达FBL蛋白预示着ESCC患者预后不佳。
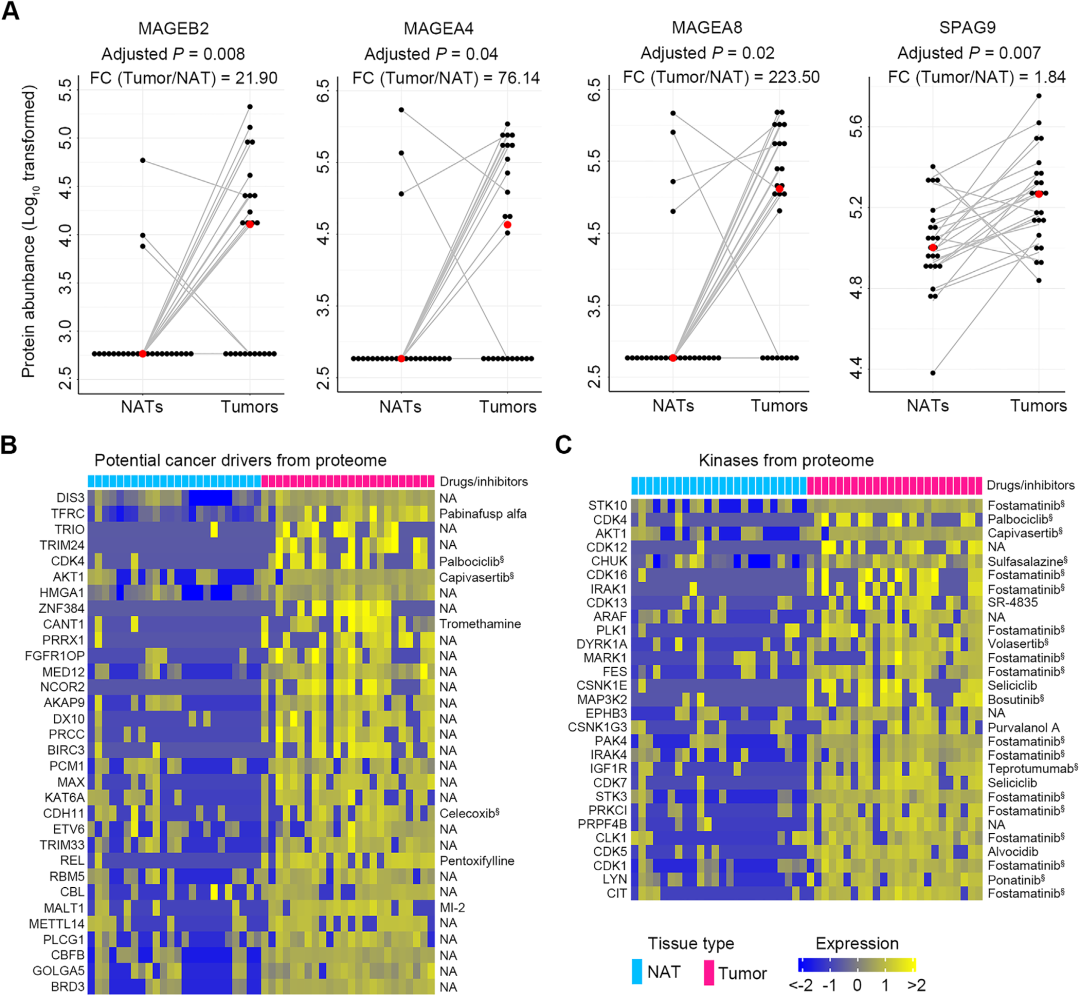
6. 发现肿瘤抗原和靶向潜在的肿瘤驱动因子和重要激酶的药物
新肿瘤抗原(包括CT抗原)的鉴定将为开发用于癌症免疫治疗的疫苗提供更多的机会。通过分析蛋白质组结果,研究者发现了4个已知的CT抗原MAGEB3、MAGEA4、MAGEA8和SPAG9在ESCC组织中显著上调,变化倍数(FC)从1.84到223.50。紧接着,研究者将蛋白质组结果与已知的潜在癌症驱动因子列表和激酶列表进行比较,分别发现了32个潜在肿瘤驱动因子和29个激酶在ESCC癌组织中有4倍以上的表达上调。通过在两个药物数据库Drugbank和PKIDB进行检索发现,21.88%(7/32)的癌症驱动因子和86.21%(25/29)的激酶有靶向抑制剂。这些抑制剂可以作为ESCC的新疗法进行测试。
研究总结
研究者对24对人食管鳞状细胞癌(ESCC)癌组织和配对的正常邻近组织进行了转录组、蛋白质组、磷酸化蛋白质组和代谢组特征分析,以确定ESCC的新的分子特征和潜在的治疗靶点。结果显示,有一小群基因与ESCC活跃的转录后和翻译后调控有关。通过分析蛋白质组学、磷酸化蛋白质组学和代谢组学数据,揭开了与癌症病因密切相关的ESCC相关信号和代谢途径的网络。蛋白质组和磷酸化蛋白质组数据分析显示,参与RNA转录、加工和代谢的某些途径在ESCC中受到激活。此外,研究者发现了与ESCC预后密切相关的蛋白质,其中FBL对ESCC细胞的体外和体内生长至关重要,且FBL的高表达预示着不利的预后。最后,研究者分析发现了ESCC癌组织中的CT抗原、肿瘤驱动因子及激酶,并分析了已有的靶向这些分子的药物,这将为ESCC新疗法的开发提供启发。
吉凯基因凭借多年在靶标筛选及验证服务领域的技术积累,建立的标准化 、工程化 、系统化的GRP平台,为中国研究型医生提供科研服务,加快科研成果转化。其中,多组学平台包含蛋白质组学平台和高通量测序平台:
·蛋白质组学平台拥有多台timsTOF Pro、Exploris 480高精度质谱仪,专业的Spectronaut Plusar、Mascot等分析软件,提供专业的4D、DIA、TMT、PRM、磷酸化修饰组、olink蛋白质组等检测服务,强大的机器学习算法、IPA分析、蛋白基因组分析服务,系统的生物标志物、分子分型、药物靶点、基因功能研究等解决方案,真正让广大研究型医生的科研工作更省心、更省力、更高效;
·
