【本文作者为文章一作南京鼓楼医院江波博士】
远处转移是导致癌症死亡的主要原因。临床上,经常可观察到原发肿瘤对特定器官的转移倾向;例如,乳腺癌常转移至颅内,前列腺癌多侵犯骨骼,肾癌(RCC)最常转移至肺脏,并且不同器官转移的肿瘤通常呈现出不同的药物治疗反应和预后。目前,大多数肿瘤肺转移的分子基础仍不清楚。
既往研究显示,在肾癌(RCC)中,不同器官的转移灶显示出独特的基因改变特征;譬如,8p和18q染色体的缺失以及12号染色体的扩增在肺转移中十分常见。虽然转移病灶与原发肿瘤间共享着绝大多数突变,但特征性突变是驱动器官特异性转移进化的重要因素。临床上RCC这种肺转移特征的具体机制仍需进一步解析。
2022年7月16日,南京大学医学院附属鼓楼医院郭宏骞教授团队与南京大学生命科学学院闫超课题组合作在国际著名期刊Nature Communications(2022 IF:17.694)上发表了题为“Lysosomal Protein Transmembrane 5 Promotes Lung-Specific Metastasis by Regulating BMPR1A Lysosomal Degradation”的研究成果。在这项工作中,研究团队探讨了驱动肾细胞癌肺特异性转移的机制。南京大学医学院附属鼓楼医院泌尿外科郭宏骞教授与南京大学生命科学学院闫超教授为共同通讯作者,南京鼓楼医院江波博士、赵晓智副主任医师为该论文共同第一作者。吉凯基因提供了慢病毒和TMT蛋白质组学服务。 研究方法
研究方法
体内构建RCC多器官转移模型,迭代筛选肺转移倾向的细胞亚型;转录组分析筛选鉴定出特异性肺转移的关键介导分子LAPTM5;表型上,通过慢病毒体系(吉凯基因)构建稳转细胞株,体内外实验验证功能;机制上,通过TMT蛋白质组学(吉凯基因),筛选鉴定出关键结合蛋白WWP2;基于此,进一步解析LAPTM5通过促进BMP受体BMPR1A经溶酶体途径降解的机制。
研究结果
1. 构建具有高度肺转移倾向性的肾癌(RCC)细胞系
研究者通过对荧光素酶标记的小鼠RCC细胞系Rencaluci细胞进行多次心内接种和转移克隆筛选/扩增,最终筛选到了有高度肺转移倾向性的细胞系RencaLuM2a以及有高度脑转移倾向的RencaBrM2b和有高度骨转移倾向的RencaBoM2。在接种RencaLuM2a后11天,8只小鼠中的6只发生了肺转移,而接种母细胞系(Rencaluci)的10只小鼠中仅1只小鼠发生转移。此外,接种RencaLuM2a的小鼠有显著更短的生存期。小鼠肺部生物发光图像检测发现在接种RencaLuM2a或另一个人786O细胞系来源的高度肺转移倾向性的细胞786OLuM1a后均有增强的肺转移活性。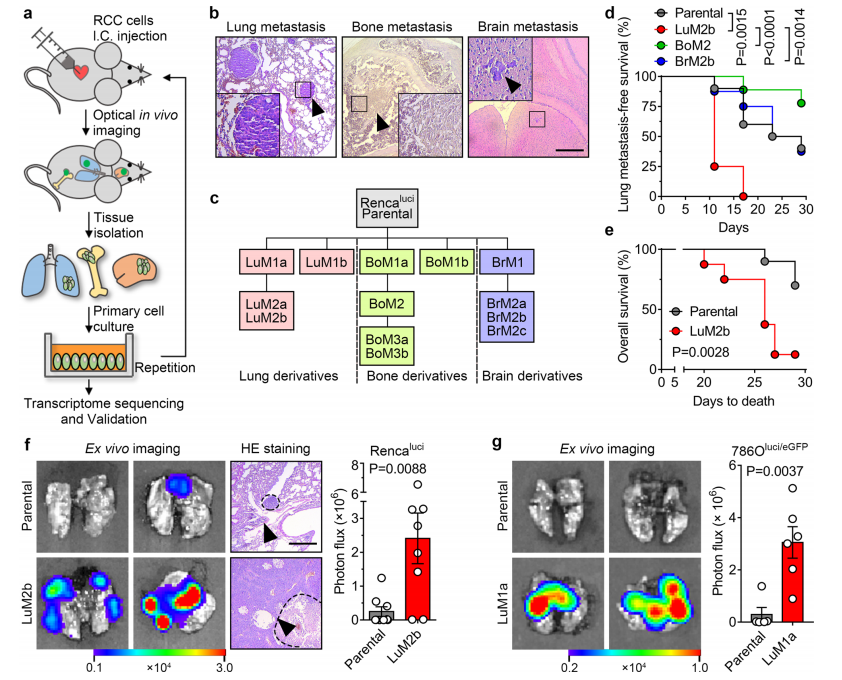
2. LAPTM5介导肺转移而非脑或者骨转移
研究者对获得的具有不同器官转移倾向性的Renca细胞系进行转录组测序。PCA结果显示,肺转移倾向性的RencaLuM2a和脑转移倾向性的RencaBrM2b相邻,且均与RencaBoM2或母细胞Rencaluci远离。这一结果与此前报道称肺转移和脑转移有共有的介导因子相一致。研究者将RencaLuM2a分别和RencaBrM2b、RencaBoM2或Rencaluci相比,分别得到562、942和276个上调基因,其中共有基因为69个,与一个已公开的人RCC数据进行比较,找到3个重合基因,分别是组织蛋白酶S(CTSS)、溶酶体跨膜蛋白5(LAPTM5)和胰岛素样生长因子结合蛋白5(IGFBP5)。其中LAPTM5在RencaLuM2a中更显著上调,且其上调仅在肺转移中被检测到,而在脑和骨转移中并未被检测到。这些结果表明,LAPTM5可能与RCC的肺转移相关。
研究者随后对RencaLuM2a细胞分别进行LAPTM5过表达和敲低,并检测其在体内对肾癌肺转移的影响。结果表明,过表达LAPTM5显著加速肾癌肺转移,而敲低LAPTM5则显著抑制肺转移。LAPTM5的变化并不影响骨和脑转移。786OLuM1a细胞上也得到了类似的结果。此外,在RencaBrM2b和RencaBoM2中异位表达LAPTM5能改变这两种细胞的亲器官性,增强细胞转移到肺部的能力。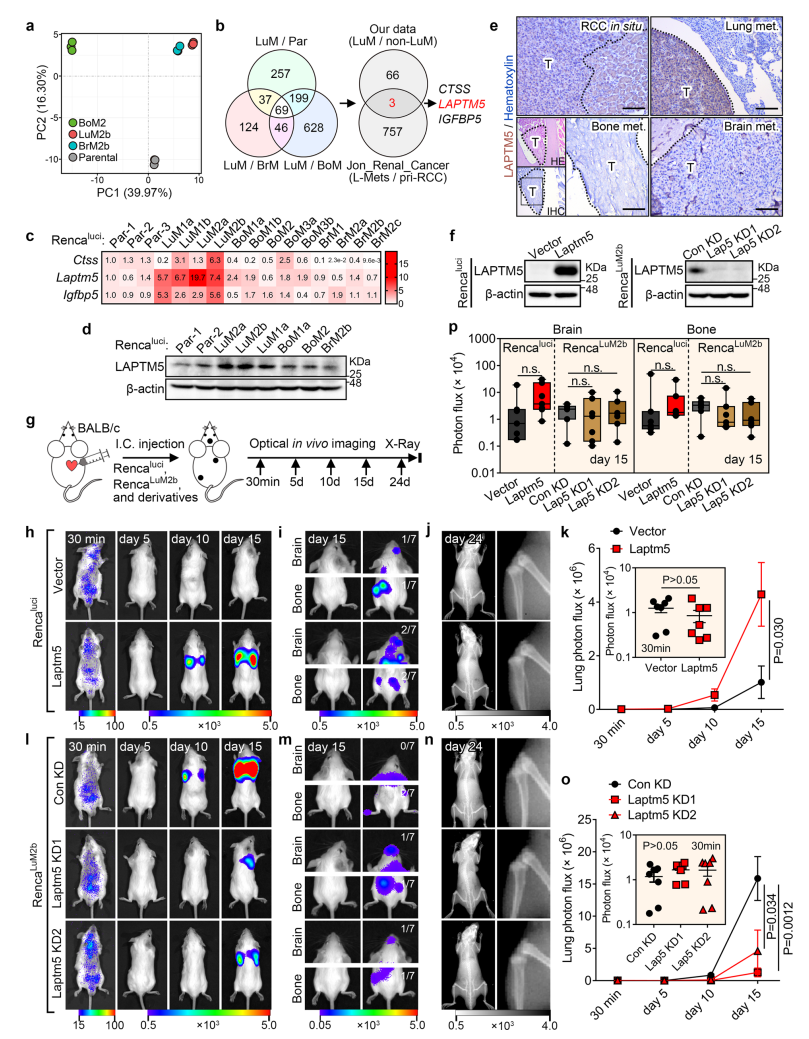
3. LAPTM5促进RCC细胞自我更新和肿瘤干细胞样特性
随后,研究者探索LAPTM5究竟影响了RCC的哪些功能而促进了肝转移。在排除了LAPTM5对细胞增殖、EMT、侵袭及凋亡的影响后,研究者关注LAPTM5对细胞自我更新能力的影响。将RencaLuM2a和Rencaluci细胞通过尾静脉注射入小鼠,并观察不同时间点小鼠肺组织中的癌细胞渗入情况。结果表明,过表达LAPTM5不能加强Rencaluci渗入肺组织,但敲低LAPTM5可以抑制肺基质中RencaLuM2a的生长。综合以上结果表明,LAPTM5可能诱导了肺基质中转移的起始和肿瘤的生长。紧接着,作者通过3D肿瘤球体形成实验明确LAPTM5参与细胞自我更新,且LAPTM5可增强癌细胞在皮下和被膜下的肿瘤起始。
此外,研究者还注意到,在侵袭性和转移性RCC的4个最常见胚胎干细胞转录因子NANOG、OCT4、SOX2和KLF4中的3个在LAPTM5过表达的Renca和786O细胞中高表达。这意味着,LAPTM5可能促进和保持了RCC细胞干细胞样特性。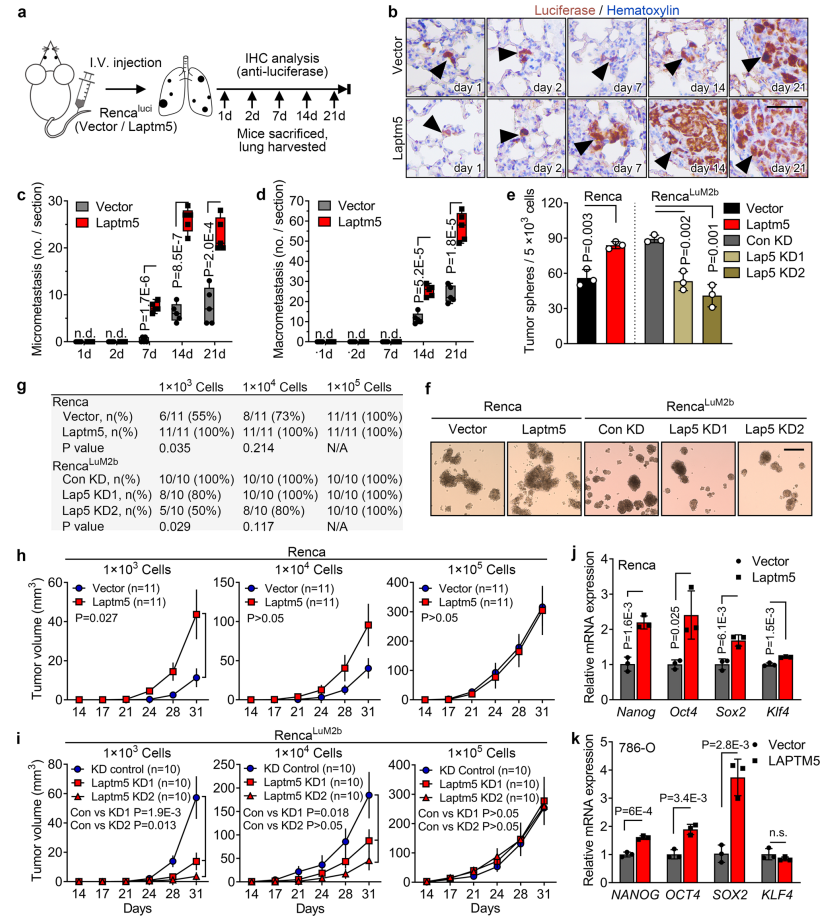
4. LAPTM5调控肿瘤干细胞特性和介导肺特异性转移的机制
(1)LAPTM5抑制BMP信号
研究者通过对TCGA数据库中肾透明细胞癌和乳头状肾细胞癌数据的GSEA分析发现,BMP信号通路是唯/一/一条与LAPTM5显著负相关的信号通路。研究者在肺组织中检测到了高水平的Smad 1/5/8磷酸化,因此研究者专注于BMP途径。通过后续实验明确LAPTM5通过抑制肺微环境中BMP信号的激活来增强RCC细胞的干细胞样特性。
(2)LAPTM5在转录后水平下调BMPR1A
据报道,BMP类似于其他TGF-β家庭成员,它们通过两种丝氨酸-苏氨酸激酶跨膜受体——I型和II型BMP受体(BMPR)发挥作用。研究者探究LAPTM5是否可以在RCC中调控BMP。RT-PCR结果显示,除Bmpr1和Acvr1c外,其他BMPR均在Renca细胞中表达,且BMPR mRNA表达水平不受LAPTM5的影响。然而,10ng/ml的小鼠BMP4处理后,在LAPTM5过表达的Renca细胞中,BMPR1A蛋白水平随着处理时间逐渐降低,而BMPR1A的mRNA水平不受影响。在786O细胞中也得到了类似的结果。对应地,BMPR1A蛋白水平在LAPTM5沉默的RencaLuM2a细胞中上调。综合这些结果表明,LAPTM5通过转录后机制负调控BMPR1A。
(3)LAPTM5促进BMPR1A溶酶体内吞且与WWP2结合
为了研究LAPTM5是如何调控BMPR1A的,研究者在786O细胞和Renca细胞中分别过表达flag-LAPTM5,并使用TMT蛋白质组学对flag-LAPTM5 CO-IP后的产物进行检测以寻找LAPTM5结合的蛋白。TMT蛋白质组学分别检测到了151和131个蛋白,其中有9个共有蛋白。后续实验明确了LAPTM5和其中一个共有蛋白WWP2(含WW结构域的E3泛素蛋白连接酶2)结合,且BMPR1A也在同一个蛋白复合体中。LAPTM5和WWP2的结合需要WW3结构域,而C2结构域以及前两个及最后一个WW结构域并不重要。随后的实验表明,LAPTM5促进了BMPR1A的内吞作用。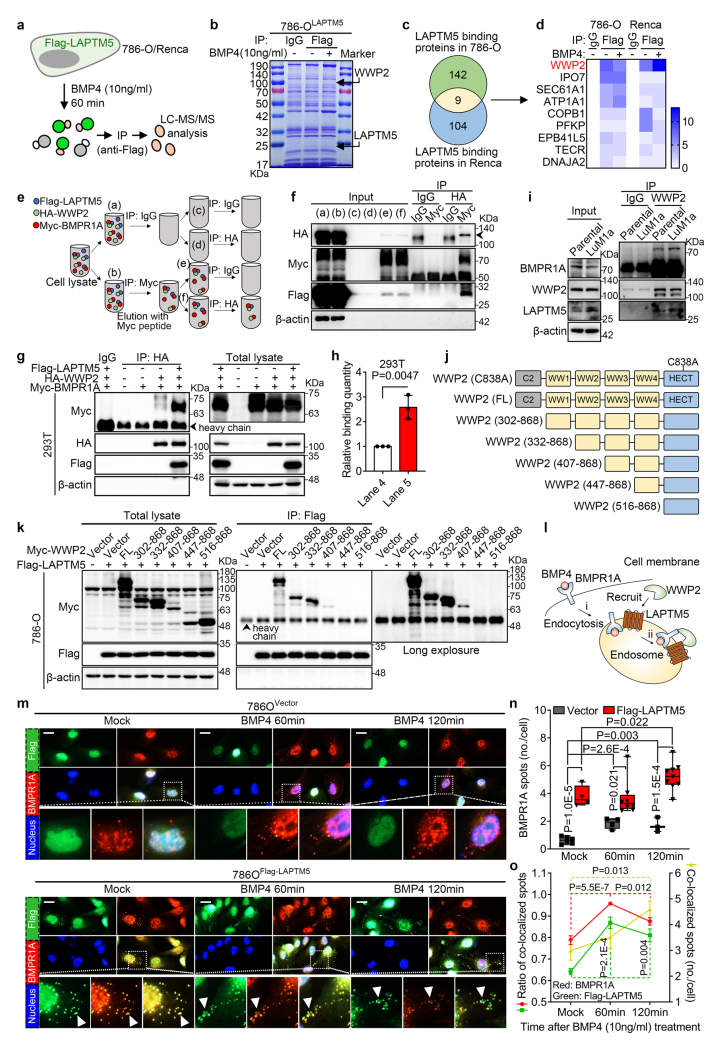
(4)WWP2介导BMPR1A基于溶酶体的泛素化和降解
WWP2是一种泛素连接酶,研究者明确了WWP2可以泛素化BMPR1A,而这种作用会被LAPTM5加强。总体上,WWP2促进了BMPR1A的多泛素化,基于LAPTM5/WWP2的溶酶体途径介导了BMPR1A的降解。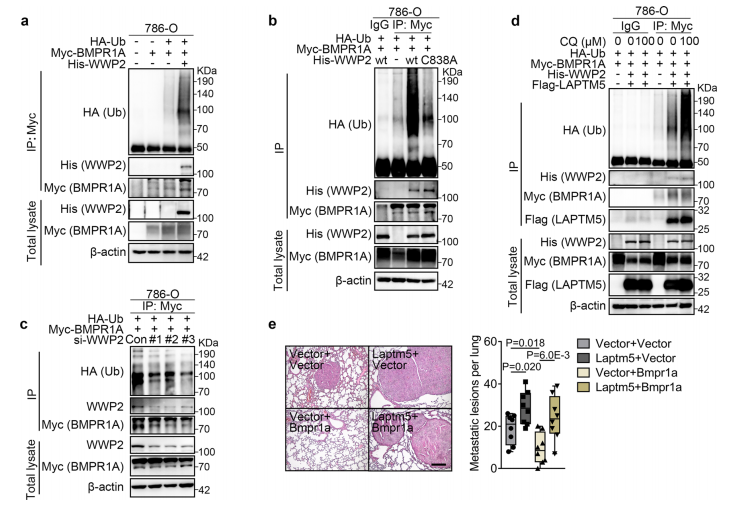
5. LAPTM5和BMPR1A负相关,且可以预测肺转移
研究者继续在临床样本中检测了LAPTM5和BMPR1A的表达模式。结果表明,LAPTM5在肺转移样本中显著高表达,而BMPR1A在肺转移样本中低表达。在RCC转移中,LAPTM5和BMPR1A表达呈密切负相关关系。在原发癌样本中也检测到了类似的结果。单变量和多变量逻辑回归分析显示,LAPTM5和组织学分级一样,是RCC肺转移的独立预测因子。高LAPTM5表达的原发RCC患者有更少的转移性无生存和总生存。LAPTM5表达水平可作为RCC患者肺转移和生存的独立预后因子。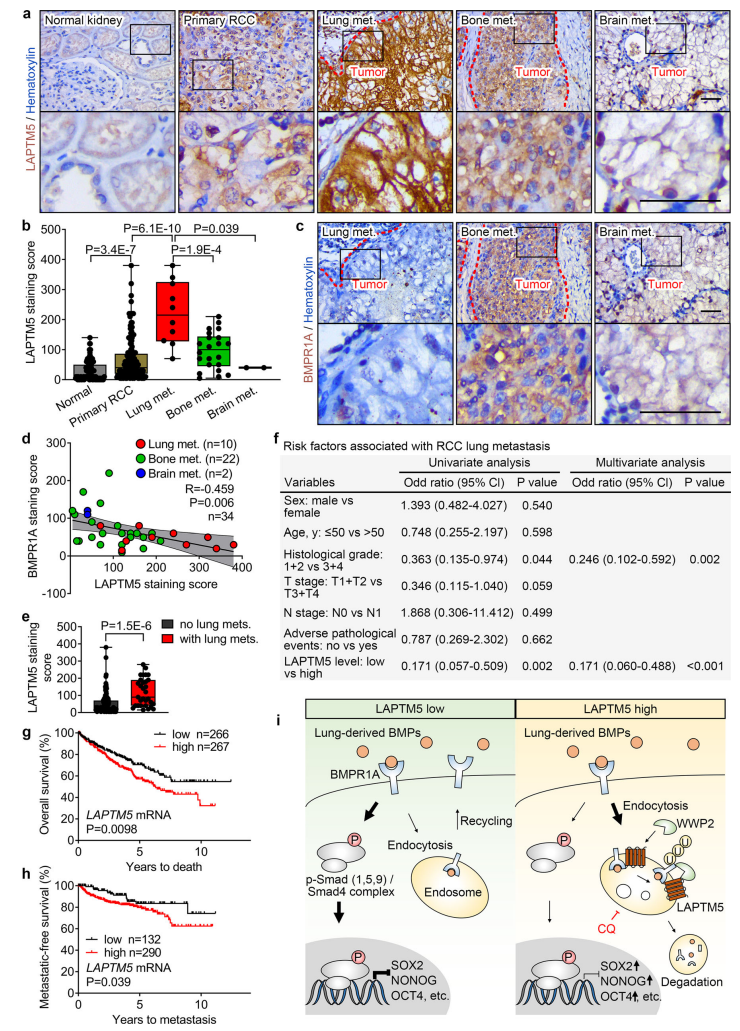
6. LAPTM5在多种癌症的肺转移中被特异性激活
研究者分析已报到的其他癌种的数据发现,LAPTM5在多种癌种肺转移中高表达。在小鼠4T1luci细胞(小鼠乳腺癌细胞)和人MDA-MB-231乳腺癌细胞系中过表达LAPTM5可以促进肿瘤球体形成,沉默LAPTM5抑制球体形成。LAPTM5还增加了4T1luci细胞在接种入乳腺时在体内形成原位肿瘤的能力。更重要的是,LAPTM5过表达导致肺内转移性病变形成的增加,而LAPTM5敲低则显著抑制肺转移。沉默LAPTM5加速了MDA-MB-231细胞中对BMP4处理反应的Smad 1/5/9的磷酸化。免疫沉淀也证实了4T1luci细胞中LAPTM5和WWP2的相互作用。在MDA-MB-231中同时检测到了LAPTM5和BMPR1A的共定位。用10ng/ml BMP4处理细胞,BMPR1A斑点显着增加,且LAPTM5过表达促进了MDA-MB-231细胞中BMPR1A的内吞。WWP2也被发现结合BMPR1A并促进其在MDA-MB-231细胞中的降解。总之,这些数据显示,肺转移中LAPTM5的活化是多种人类癌症的共同分子事件,并且基于LAPTM5/WWP2的溶酶体调节途径介导了BMPR1A泛素化和降解。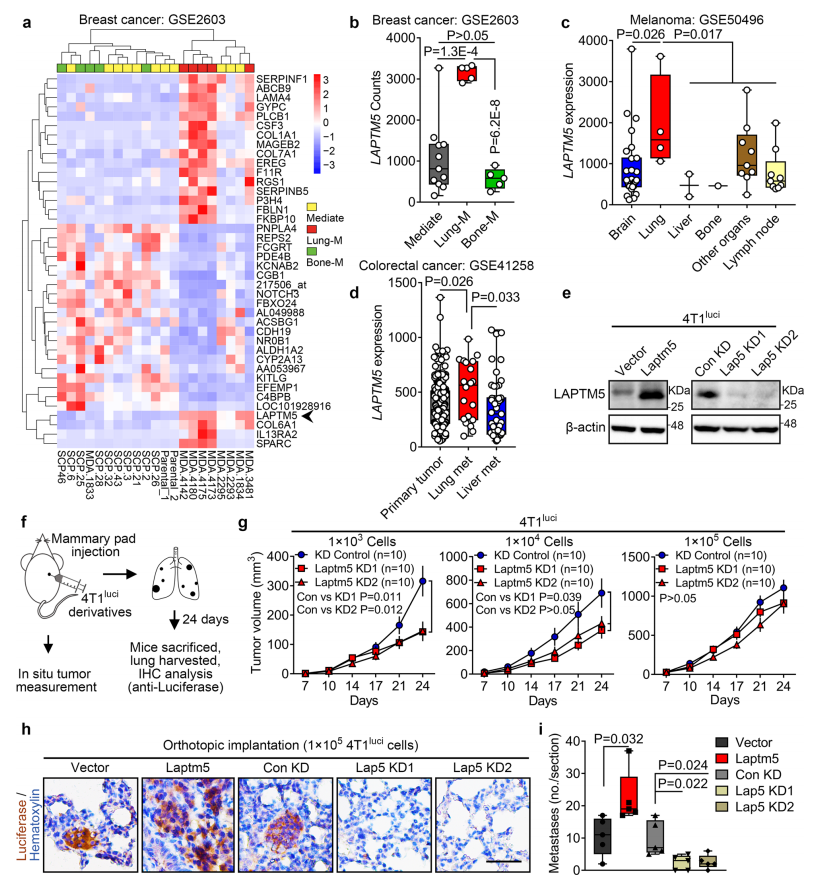 研究结论
研究结论
高肺转移倾向的RCC细胞亚型进行组学分析,结合临床样本验证,鉴定出肺转移关键分子LAPTM5。验证发现,LAPTM5在肺转移细胞株中特异性活化,外源性操控LAPTM5的表达显著影响小鼠体内RCC细胞的肺转移潜能,但对骨转移和脑转移潜能没有明显影响。表型方面,LAPTM5并不影响RCC细胞的增殖、迁移、侵袭以及抗凋亡能力,但可显著促进肺部定植的循环RCC细胞在肺部微环境中的活化。检测发现,LAPTM5能够上调RCC细胞中NANOG、OCT4、SOX2等干性基因的表达,促进RCC细胞的体内外成瘤能力。对TCGA数据库中的透明细胞型(KIRC)与乳头细胞型(KIRP)肾癌队列样本进行GSEA分析,发现BMP通路可能是LAPTM5负调控的关键通路。LAPTM5可通过下调BMP的受体BMPR1A来抑制BMP信号,从而激活RCC细胞在肺组织中的生长。在机制上,LAPTM5能够促进BMPR1A的内吞以及与WWP2(一种E3泛素化连接酶)的结合,进而介导BMPR1A的溶酶体泛素化途径降解。最后,研究人员在临床RCC原发肿瘤及转移灶样本中验证了上述机制。有意思的是,LAPTM5在肺转移细胞系中特异性活化的现象在其他肿瘤如乳腺癌、黑色素瘤以及结直肠癌中也得到了初步验证,提示LAPTM5上调可能是多种肿瘤肺转移的共性机制。这一新的肺转移机制可为多种癌症的肺转移提供新的潜在药物研发靶点。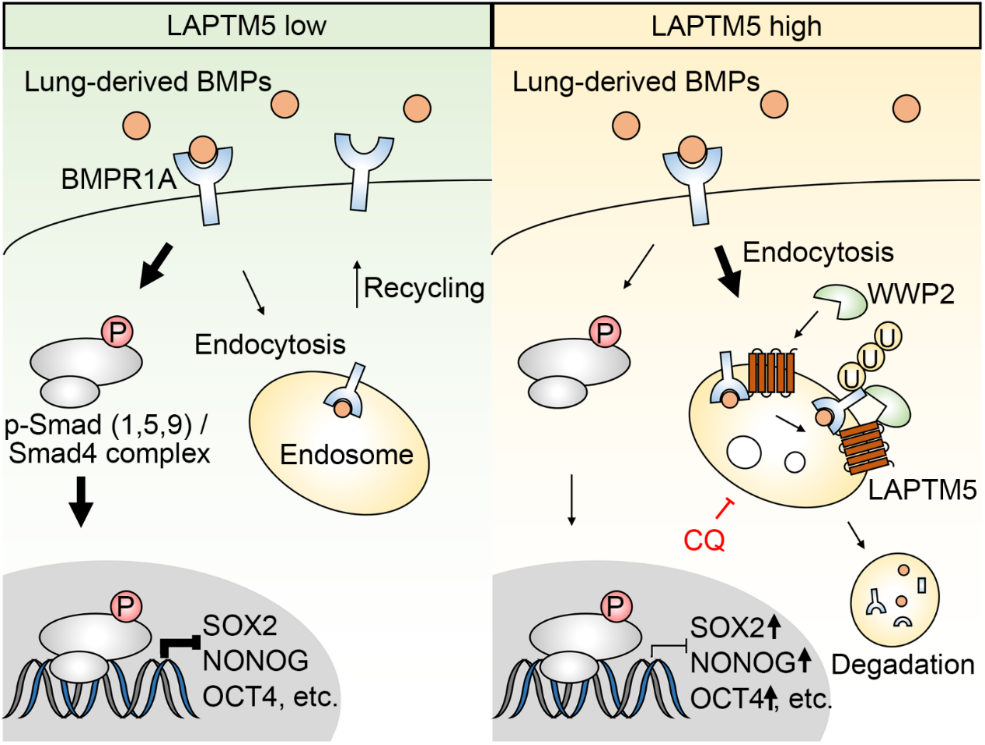 LAPTM5促进肿瘤特异性肺转移的作用模式图
LAPTM5促进肿瘤特异性肺转移的作用模式图
吉凯助力
此项研究中吉凯基因提供了慢病毒和TMT蛋白质组学服务。

此项研究南京大学医学院附属鼓楼医院泌尿外科郭宏骞教授与南京大学生命科学学院闫超教授为共同通讯作者,南京鼓楼医院江波博士、赵晓智副主任医师为该论文共同第一作者。
左:郭宏骞教授;右:江波博士
吉凯基因凭借多年在靶标筛选及验证服务领域的技术积累,建立的标准化 、工程化 、系统化的GRP平台,为中国研究型医生提供科研服务,加快科研成果转化。其中,多组学平台包含蛋白质组学平台和高通量测序平台:
·蛋白质组学平台拥有多台timsTOF Pro、Exploris 480高精度质谱仪,专业的Spectronaut Plusar、Mascot等分析软件,提供专业的4D、DIA、TMT、PRM、磷酸化修饰组、olink蛋白质组等检测服务,强大的机器学习算法、IPA分析、蛋白基因组分析服务,系统的生物标志物、分子分型、药物靶点、基因功能研究等解决方案,真正让广大研究型医生的科研工作更省心、更省力、更高效;
·高通量测序平台分为常规测序服务和单细胞测序服务:单细胞测序拥有10x和BD两个平台,提供单细胞RNA-seq、单细胞核测序、单细胞混样RNA-seq、单细胞TCR/BCR、单细胞(RNA+ATAC)、空间转录组测序等服务;常规测序服务提供meRIP-seq(m6A/m1A/m7G/m5C 等RNA甲基化修饰测序)、acRIP-seq(ac4C RNA乙酰化修饰测序)、ATAC-seq、Ribo-seq(翻译组测序) 、mRNA/miRNA/LncRNA/circRNA-seq、全转录组测序(两文库/三文库)、外泌体miRNA/LncRNA-seq、WGS/WES、WGBS、RRBS、BSAS等服务。











左:郭宏骞教授;右:江波博士
