百趣代谢组学资讯: 哮*真的和痰液有关系?来问问科研大佬们怎么看。
下面跟着小趣一起,透过「痰液代谢组学」认识不同炎症亚型哮*吧。
近日,四川大学华西医院王刚教授团队在Allergy
Asthma & Immunology Research(IF=5.096)上发表了题为"Sputum Metabolomic Profiling Reveals
Metabolic Pathways and Signatures Associated With Inflammatory Phenotypes in
Patients With Asthma"的论文。
四川大学华西医院王刚教授是论文第一通讯作者,刘影博士是论文第一作者;上海百趣代谢组学技术研究中心创始团队刘志鹏研究员和研究人员王洪光为论文共同作者。百趣生物为本次研究提供了非靶向代谢组学+靶向代谢组学服务。
哮*是一种严重的全球性慢性炎症性气道疾病,其特点是气道高反应性和可逆性气道阻塞导致的反复发作的*息、气短、胸闷和**。同时,哮*也是一种具有不同表型和内型的异质性疾病,其中哮*的炎症表型(嗜酸性粒细胞性哮*[EA]、中性粒细胞性哮*[NA]和少粒细胞性哮*[PGA])根据诱导的痰粒细胞不同比例而被广泛认知。
尽管可以为不同炎症表型的患者量身定制管理方法,但针对特定炎症表型,尤其是NA的治疗策略尚且缺乏,这代表了哮*的医疗需求有待被满足。同时,驱动哮*不同炎症表型的分子机制知之甚少,并且可能是异质的。因此,识别特定的生物标志物并了解哮*不同炎症表型的分子机制非常重要,这可能会导致更加个性化的医疗。
本研究通过非靶向与靶向代谢组学方法,以识别不同炎症性哮*表型患者的痰液代谢组学特征和潜在的分子途径,以期探索这些特征是否与控制哮*和加重哮*风险相关。
一、样本设置
发现集(discovery set)119个痰液样本:
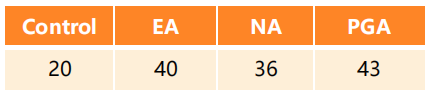
验证集(validation set)114个痰液样本:
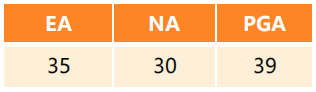
二、临床特征
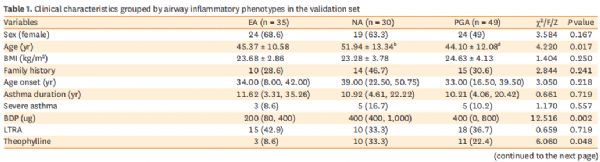
验证集中,炎症细胞因子结果显示在哮*表型中,EA患者的IL-5水平最高,而TNF-α、IL-1β、IL-8水平最低(p<0.05)。与之相反,NA组IL-1β水平最高,IL-5水平最低(均P<0.05)(表1)。在12个月的随访中,有3例(10%)NA患者和3例(6.1%)PGA患者失访。最后,108例哮*患者(EA,n=35;NA,n=27;PGA,n=46)纳入哮*加重分析。结果显示,不同表型组中,严重哮*发作的患者比例(EA
vs NA vs PGA:17.1% vs 37% vs 6.5%,P=0.004)和严重哮*发作次数的频率(EAvsNA
vs PGA: 0.29±0.75 vs 0.70±1.33 vs 0.09±0.35,P=0.004)存在显著差异(表1)。
表1. 数值表示为平均值±标准差、数字(%)或中位数(下四分位数、上四分位数)。EA,嗜酸性粒细胞性哮*;NA,中性粒细胞性哮*;PGA,少粒细胞哮*;BMI,体重指数;BDP,二丙酸倍氯米松;LTRA,白三烯受体拮抗剂;SPT,皮肤点刺试验;ACQ,哮*控制问卷;AQLQ,哮*生活质量问卷;FEV1,一秒用力呼气量;FVC,用力肺活量;BDR,支气管扩张剂反应;FeNO,呼出的一氧化氮分数;IgE,免疫球蛋白E;TNF,肿瘤坏死因子;干扰素,干扰素;IL,白细胞介素;MDC,巨噬细胞衍生的趋化因子。与EA组比, aP<0.01, bP<0.05; 与NA组相比, cP<0.01, dP<0.05。
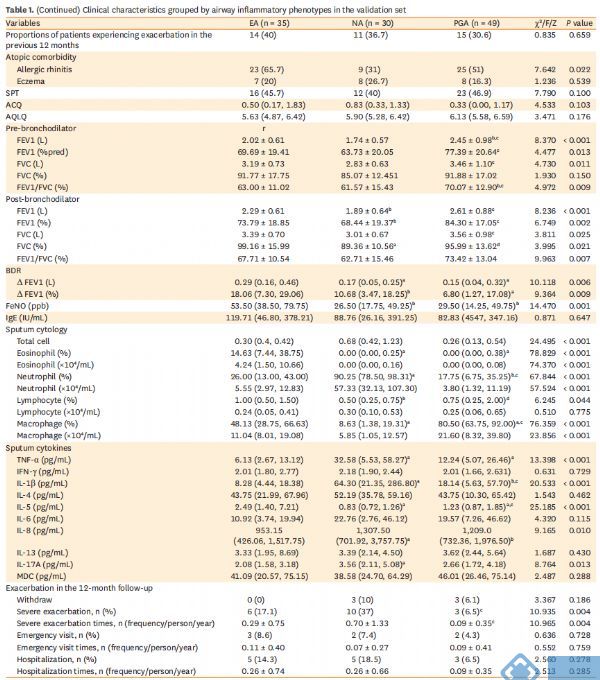
三、非靶向代谢谱可区分发现集中不同炎症性哮*表型和健康受试者
OPLS-DA分析表明不同哮*炎症表型之间明显分离。此外,哮*组也与健康对照组明显分开(图1)。每个模型中Q2截距的低值表明这些模型的稳健性,因此在所有比较中显示过拟合的风险较低,组间差异显著。
图1. 发现集中,非靶向代谢谱在不同炎症表型哮*和健康受试者中有所区别。(A-D) 不同炎症性哮*表型和健康受试者的PCA模型评分图;(E-H) 不同炎症性哮*表型与健康受试者OPLS-DA模型的评分图;(I-L) 不同炎症性哮*表型与健康受试者OPLS-DA模型的置换检验
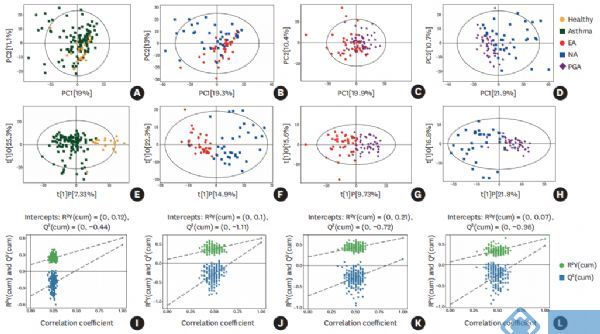
结合单变量和多变量统计分析,基于OPLS-DA模型的VIP>1、倍数变化<0.83或>1.2和FDR<0.05,在不同的哮*表型和健康受试者之间共发现77种差异代谢物(图2)。
图2. 发现组中不同炎症表型哮*和健康受试者痰样本中差异代谢物热图
四、发现集中的代谢组学通路分析
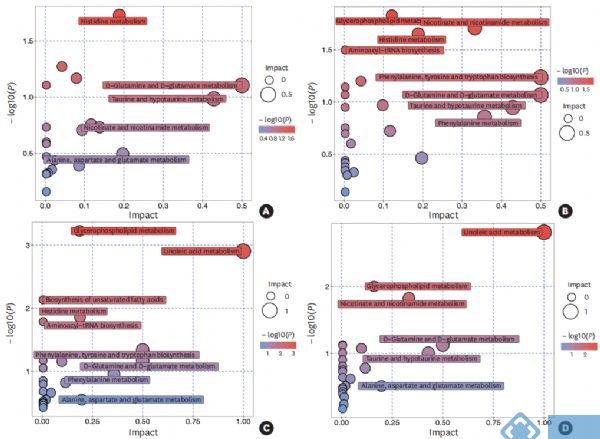
应用MetPA代谢组学通路拓扑结构富集分析方法来评估不同哮*表型和健康受试者中病理生理机制潜在途径的重要性(图3)。结果显示,组氨酸代谢途径在哮*组和健康对照组之间存在差异(P=0.019;影响值=0.189)。EA和NA之间的差异代谢物富集在甘油磷脂代谢(P=0.015;影响值=0.121)、烟酸和烟酰胺代谢(P=0.020;影响值=0.332)和组氨酸代谢(P=0.022;影响值=0.189)。EA和PGA之间的差异代谢物富集在甘油磷脂代谢(P=0.001;冲击值=0.186)、亚油酸代谢(P=0.001;影响值=1.000)、组氨酸代谢(P=0.014;影响值=0.189)和苯丙氨酸、酪氨酸和色氨酸的生物合成(P=0.046;影响值=0.500)。NA和PGA之间的差异代谢物富集在亚油酸代谢(P=0.002;影响值=1.000)、甘油磷脂代谢(P=0.010;影响值=0.160)和烟酸、烟酰胺代谢(P=0.015;影响值=0.332)。
图3. 基于能区分不同炎症表型哮*和健康受试者痰样本的代谢物的代谢通路分析。(A) 哮*与健康;(B) EA和NA;(C) EA和PGA;(D) NA和PGA。圆圈表示可能涉及类分离的代谢途径。EA,嗜酸性哮*;NA,中性粒细胞哮*;PGA,
少粒细胞性哮*。
五、靶向定量验证集中不同炎症性哮*表型与健康受试者之间的差异代谢物
经过文献调研和靶标定量方法检测分析评估,选择了39个差异表达代谢物,在验证集患者中进行靶向定量,其中24种代谢物在哮*炎症表型之间显著差异表达(表2),其中9种代谢物的显著P值为0.001或更低。组胺以及组氨酸代谢相关代谢物的表达量最高,而5-L-谷氨酰基-L-丙氨酸、烟酰胺、二氢胸腺嘧啶、L-亮氨酸、L-苯丙氨酸、丙氨酰亮氨酸、苯丙氨酰丝氨酸、苯丙氨酰苯丙氨酸在EA患者中表达量最低。这些数据与代谢通路拓扑结构富集分析结果一致,表明组氨酸代谢可能在EA中起重要作用。在NA患者中,涉及嘌呤代谢、乙醛酸和二羧酸代谢、牛磺酸和亚牛磺酸代谢以及氨酰tRNA生物合成的腺苷5'-单磷酸、甘油酸、牛磺酸、二氢胸腺嘧啶、L-亮氨酸、酪胺、L-谷氨酸、丙氨酰亮氨酸、苯丙氨酰丝氨酸和苏氨酰苯丙氨酸的浓度最高,而甘油磷脂代谢相关代谢物甘油磷酸胆碱的浓度最低,与之相反,PGA中甘油磷胆碱的浓度最高。而且,PGA患者的不饱和脂肪酸相关代谢产物,十七烷酸和油酸的生物合成也最高,但十二烷酸的浓度最低(表2)。
表2. 数值表示为中位数(下四分位数、上四分位数)。EA,嗜酸性粒细胞性哮*;NA,中性粒细胞性哮*;PGA,少粒细胞哮*。与EA组比,
aP<0.01, bP<0.05; 与NA组相比,
cP<0.01, dP<0.05。
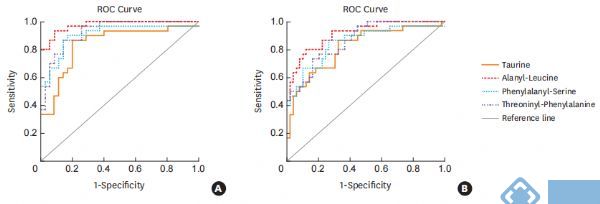
此外,通过受试者工作特征(ROC)曲线检测这些差异表达的代谢物,以区分不同的炎症哮*表型。牛磺酸、丙氨酰亮氨酸、苯丙氨酰丝氨酸和苏氨酰苯丙氨酸可作为鉴别NA与EA或PGA的候选代谢标记物,其AUC范围为0.816~0.975(P<0.05)(图4)。然而,由于单一代谢物的AUC均小于0.7,故不能有效区分EA和PGA。
图4. 区分NA和EA (A) 或NA和PGA
(B) 的代谢物受试者工作特征(ROC)曲线。EA,嗜酸性哮*;NA,中性粒细胞哮*;PGA, 少粒细胞性哮*。
六、验证集中差异代谢物与临床指标和炎症特征的相关性
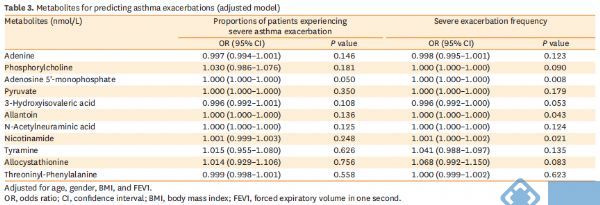
相关性分析显示,差异表达的代谢物与所有哮*受试者的肺功能、哮*控制和炎症特征相关(图5)。在12个月的随访中,使用logistic回归和负二项回归模型探讨所有哮*患者痰液代谢物与严重哮*发作之间的关系。结果显示,腺苷5'-单磷酸与严重哮*加重显著相关(表3)。校正年龄、性别、BMI和FEV1%之后,腺苷5'-单磷酸与经历严重哮*发作的患者比例以及严重哮*发作频率呈正相关(RRadj=1.000,95%CI=[1.000,1.000],P=0.050;RRadj=1.000,95%CI=[1.000,1.000],P=0.008)。同时,尿囊素和烟酰胺与严重哮*发作频率均呈正相关(RRadj=1.000,95%CI=[1.000,1.000],P=0.043;RRadj=1.001,95%CI=[1.000,1.002],P=0.021)。此外,对嗜酸性哮*(EA)或非嗜酸性哮*(NEA)进行了亚组分析。结果显示,腺苷5'-单磷酸仍与NEA组的严重哮*恶化显著相关,但与EA组无关。而且,我们还发现腺嘌呤、别胱硫醚和烟酰胺也与NEA组严重哮*发作显著相关。然而,由于EA组的样本量有限,只发现酪胺与严重哮*发作的频率相关。
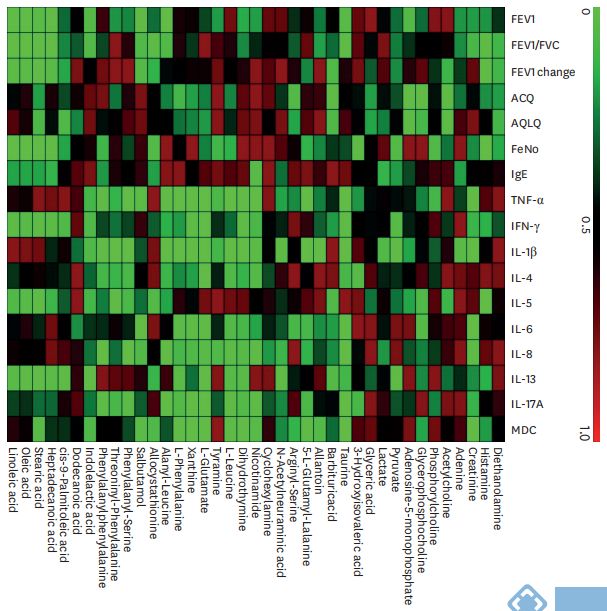
图5. 验证集中所有哮*受试者差异代谢物与临床和炎症特征相关性热图。FEV1,一秒用力呼气量;FVC,用力肺活量;ACQ,哮*控制问卷;AQLQ,哮*生活质量问卷;FeNO,呼出的一氧化氮分数;IgE,免疫球蛋白 E;TNF,肿瘤坏死因子;干扰素,干扰素;IL,白细胞介素;MDC,巨噬细胞衍生的趋化因子。
表3. 根据年龄、性别、BMI和FEV1进行了校正。OR,优势比;CI,置信区间;BMI,体重指数;FEV1,一秒用力呼气量。
七、结论
不同炎症性哮*表型的代谢组学研究分析可以发现,不同亚型间累计有77个差异显著代谢物变化和5条差异显著代谢通路变化。这些代谢组学通路主要是组氨酸代谢、甘油磷脂代谢、烟酸和烟酰胺代谢、亚油酸代谢、以及苯丙氨酸、酪氨酸和色氨酸的生物合成。此外,还发现差异代谢物与哮*的临床和炎症特征相关,这些代谢物可能能够作为不同炎症性哮*表型的潜在治疗靶点。
文/阿趣代谢组学